Protonová radioterapie se od fotonové radioterapie odlišuje jinou absorpcí ionizujícího záření ve tkáních. Obecně lze říci, že protonová radioterapie má lepší dávkovou distribuci (rozložení dávek záření) v oblasti středních a nízkých dávek záření a obdobnou dávkovou distribuci v oblasti vysokých dávek. Nízké a střední dávky jsou zdrojem pozdních a velmi pozdních nežádoucích účinků radioterapie, a proto má být její použití zvažováno v situacích, kdy se předpokládá vyléčení nemocného a dlouhá předpokládaná doba přežití. Druhou situací, při které je použití protonů vhodné, jsou nádorová onemocnění lokalizovaná v oblasti zdravých tkání, které mohou být v krátkodobém horizontu zářením poškozeny a fotonová radioterapie neumožňuje aplikaci dávek dostačujících k eradikaci nádoru.
Indikace k protonové radioterapii v PTC reflektují mezinárodní doporučení (např. ASTRO Proton Beam Therapy Model Policy, poslední update 2017) a také indikace užívané v jiných protonových centrech. Příkladem může být souhrn publikovaný autory z USA sdružených v tzv. Pediatric Proton Consortium Registry, nebo publikace popisující indikace užívané ve 40 protonových centrech nejen v USA, ale i Evropě a dalších kontinentech, na které se podílelo i PTC.
Cílové objemy, frakcionace i timing radioterapie u jednotlivých podskupin dětských tumorů jsou uvedeny v příslušných pediatrických protokolech. Platí, že frakcionace, objem i dávka jsou identické jako v případě fotonové radioterapie. Výhodou protonové terapie je dosažení vyšší konformity s nižší integrální dávkou. Obecně lze říci, že na rozdíl od dospělých pacientů se neuplatňují akcelerované režimy radioterapie, standardem je normofrakcionace.
Protony vykazují charakteristický tvar hloubkového rozložení dávky. Na rozdíl od fotonů, které předávají maximum energie na povrchu a s hloubkou jejich energie klesá, protony předávají tkáni při svém průchodu jen malou část energie. Těsně před koncem dráhy protonu tkáň absorbuje většinu energie, dochází k prudkému růstu dávky a následnému prudkému poklesu k nule. Tato oblast se nazývá Braggův pík. Hloubka, ve které vzniká Braggův pík, je dána energií protonů (energie je mezi 70 a 230 MeV a maximální hloubka přibližně 30 cm).
Dochází tedy k šetření tkáně jak „před nádorem“ (z pohledu zdroje záření), tak zejména za ním. Tím je možné aplikovat předepsanou dávku do cílového objemu za současného šetření zdravých tkání (ve srovnání s fotonovým zářením), zlepšit toxicitu a tím i kvalitu života pediatrického pacienta. Zejména se předpokládá, že procento nádorů indukovaných zářením po protonové radioterapii výrazně poklesne, protože procento ozářené zdravé tkáně výrazně klesá ve srovnání s fotonovou terapií.
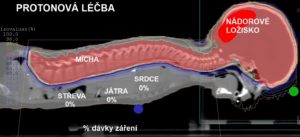
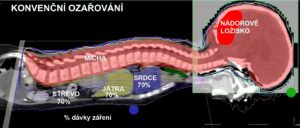
Na obr. č. 1 níže je pro ilustraci srovnána dávková distribuce (protony vlevo, fotony vpravo) u ozáření kraniospinální osy. Je zřejmé, že na zdravou tkáň je při protonové radioterapii aplikována významně nižší nebo nulová dávka.
Kniha k zakoupení prostřednictvím odkazu níže.